L’ozone excité vit moins longtemps si les trois atomes d’oxygène qui le composent sont identiques
Actualité Institut de Physique (INP)
Avril 2015
 |
En calculant la vitesse de la réaction d’échange entre l’atome d’oxygène et la molécule de dioxygène, des physiciens viennent de montrer que suite à un effet quantique d’indiscernabilité, cette réaction est dix fois plus rapide lorsque les trois atomes sont identiques que lorsqu’un des atomes est un isotope rare de l’oxygène. Ce qui signifie que l’ozone excité, qui est un intermédiaire de cette réaction, sera plus facilement stabilisé si un isotope rare est présent. |
En mettant en évidence l’importance d’un effet quantique d’indiscernabilité entre les atomes d’16O majoritaires dans l’atmosphère, des physiciens du Laboratoire Interdisciplinaire Carnot de Bourgogne - ICB (CNRS/Université de Bourgogne), en collaboration avec des collègues indiens de l’Université d’Hyderabad, viennent d’ouvrir une nouvelle voie vers la compréhension quantitative des phénomènes en jeu dans la formation de l’ozone dans la haute atmosphère. En modélisant très précisément la vitesse de réaction d’échange impliquant un atome d’oxygène et une molécule de dioxygène, les chercheurs ont montré que cette réaction est environ dix fois plus rapide lorsque les trois atomes en jeu sont trois atomes d’16O que lorsqu’un isotope rare est impliqué.
L’ozone excité, O3*, qui est l’intermédiaire de cette réaction, reste ainsi plus longtemps présent s’il comporte un 17O ou un 18O que s’il est composé de trois atomes d’16O, ce qui augmente significativement la probabilité qu’une collision stabilise cette molécule et contribue ainsi à l’enrichissement. Ce travail est publié dans la revue Journal of Physical Chemistry Letters.
En calculant la vitesse de la réaction d’échange entre l’atome d’oxygène et la molécule de dioxygène, des physiciens viennent de montrer que suite à un effet quantique d’indiscernabilité, cette réaction est dix fois plus rapide lorsque les trois atomes sont identiques que lorsqu’un des atomes est un isotope rare de l’oxygène. Ce qui signifie que l’ozone excité, qui est un intermédiaire de cette réaction, sera plus facilement stabilisé si un isotope rare est présent. On observe dans l’ozone stratosphérique, O3, formé dans la haute atmosphère, une surabondance encore mal comprise des isotopes rares 17O et 18O. Même si l’on a reproduit ce phénomène en laboratoire, son origine est encore une énigme. En mettant en évidence l’importance d’un effet quantique d’indiscernabilité entre les atomes d’16O majoritaires dans l’atmosphère, des physiciens du Laboratoire Interdisciplinaire Carnot de Bourgogne - ICB (CNRS/Université de Bourgogne), en collaboration avec des collègues indiens de l’Université d’Hyderabad, viennent d’ouvrir une nouvelle voie vers la compréhension quantitative des phénomènes en jeu dans la formation de l’ozone dans la haute atmosphère. En modélisant très précisément la vitesse de réaction d’échange impliquant un atome d’oxygène et une molécule de dioxygène, les chercheurs ont montré que cette réaction est environ dix fois plus rapide lorsque les trois atomes en jeu sont trois atomes d’16O que lorsqu’un isotope rare est impliqué.
L’ozone excité, O3*, qui est l’intermédiaire de cette réaction, reste ainsi plus longtemps présent s’il comporte un 17O ou un 18O que s’il est composé de trois atomes d’16O, ce qui augmente significativement la probabilité qu’une collision stabilise cette molécule et contribue ainsi à l’enrichissement. Ce travail est publié dans la revue Journal of Physical Chemistry Letters.
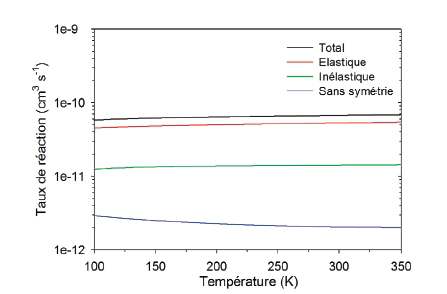
L’abondance naturelle de 16O étant d’environ 99,8%, la molécule de dioxygène O2 et l’ozone formé exclusivement de cet isotope sont dominants dans l’atmosphère et tout processus les mettant en jeu sert de référence. Dans l’état actuel des connaissances, parmi les autres processus susceptibles d’aboutir à la formation de l’ozone, c’est à la réaction de recombinaison O + O2 + M -> O3 + M que la communauté des physico-chimistes atmosphéristes attribue l’origine de l’enrichissement de l’ozone en isotopes 17O et 18O. Si la pression n’est pas trop haute, cette recombinaison à trois corps se déroule en deux étapes : d’abord la formation de l’ozone excité (à courte durée de vie) via O + O2 ->O3* (étape 1), et ensuite sa stabilisation par l’intermédiaire d’une molécule résiduelle neutre M (par exemple N2) emportant l’excédent d’énergie, O3* + M ->O3 + M (étape 2). Dans ce travail, les chercheurs se sont focalisés sur la première étape de cette réaction. Ils ont réalisé des calculs numériques du processus réactif O + O2 en faisant appel à une méthode de dynamique purement quantique et un potentiel d’interaction très précis de l’ozone O3. Cette méthode, basée sur l’équation de Schrödinger dans sa version indépendante du temps, conduit à des équations couplées en coordonnées hypersphériques et prend en compte explicitement les symétries de permutation des atomes. Leur résultat est que la vitesse de réaction est près de dix fois plus grande lorsque les trois atomes sont identiques. Cela signifie que la réaction d’échange O + O2 -> O3* -> O2 + O (très rapide avec trois atomes 16O), initiée par l’étape 1, rentre directement en compétition avec l’étape 2 du processus précédent qui voit par conséquent son efficacité altérée.
En conclusion, une meilleure compréhension de cette réaction, apportée en particulier par les résultats du groupe de l’ICB et de leurs collègues indiens, permet d’ajouter une pièce supplémentaire importante au puzzle qu’est l’enrichissement anormal de l’ozone stratosphérique.
En savoir plus :
Huge Quantum Symmetry Effect in the O + O2 Exchange Reaction, T. Rajagopala Rao1, G. Guillon1, S. Mahapatra2 et P. Honvault1,3, Journal of Physical Chemistry Letters - 6, 633-636 (2015)
Informations complémentaires :
1 Laboratoire Interdisciplinaire Carnot de Bourgogne (ICB)
2 School of Chemistry, University of Hyderabad, India
3 UFR Sciences et Techniques, Université de Franche-Comté, Besançon
Contact chercheurs :
Pascal Honvault, professeur à l’Université de Franche-Comté
Grégoire Guillon, maître de conférences à l’Université de Bourgogne
Article posté le 20/04/2015


